人體類器官作為藥物研發的三維體外平臺:機遇與挑戰
人體類器官作為藥物研發的三維體外平臺:機遇與挑戰
引用文獻:Human organoids as 3D in vitro platforms for drug discovery: opportunities and challenges
Nature Reviews Drug Discovery
Daisong Wang, Remi Villenave, Nadine Stokar-Regenscheit & Hans Clevers
摘要
類器官是從干細胞衍生出的三維結構,能夠重現相應組織的關鍵結構和功能特征。與傳統的二維細胞系相比,人體類器官能提供更接近人體生理的實驗模型。其能夠捕捉人體組織的復雜性和異質性,有助于研究疾病機制、藥物療效和毒性。由患者樣本建立的類器官還能評估個體對藥物的反應。在本綜述中,我們探討了類器官在藥物發現中的應用。我們概述了生成和維持類器官的當前方法,考察了其在疾病建模、藥物篩選和安全性評估方面的應用,并考慮了監管方面以及其在藥物發現中更廣泛應用所面臨的挑戰。衰新型肝臟環試驗將改變藥物安全性評估。
章節
介紹
疾病建模
安全性評估的應用
類器官吸收和代謝的檢測
當前挑戰的潛在解決方案
監管機構的挑戰與機遇
結論
介紹
類在藥物研發領域,體外模型發揮著關鍵作用,為研究細胞對藥物的反應提供了明確的實驗系統。人類細胞系一直以來都是藥物研發的主力,這得益于其相對簡單、成本低以及在各研究實驗室中易于獲取的特點。細胞系通常源自腫瘤,并已被適應在二維塑料表面生長。因此,細胞系無法代表組織結構,也不包含個體器官中所有功能細胞類型。這促使人們探索更接近生理狀態的三維培養系統,例如類器官,它們能更精確地模擬體內微環境。與動物實驗相比,類器官更具成本效益,能夠進行高通量篩選(HTS),同時避免了動物實驗中的物種差異和倫理問題。Mina Bissell及其同事通過使用基質膠(一種類似細胞外基質的水凝膠)開創了上皮細胞的三維培養。在三維基質膠培養環境中,細胞之間以及細胞與基質之間的相互作用更接近生理狀態。事實上,Mina Bissell證明了,從乳腺中提取的上皮細胞在基質膠中能夠形成三維的腺體結構,這些類器官甚至能夠被誘導分泌乳汁。
利用多能干細胞(PS 細胞)的類器官技術的發展可追溯到 20 世紀 80 年代胚胎干細胞(ES 細胞)。ES 細胞僅存在于囊胚期胚胎中,但在特定條件下可長期培養,理論上在合適的生長因子條件下可分化為任何細胞類型,如神經元或心肌細胞。由于 ES 細胞來源于早期人類胚胎,其使用面臨諸多物流和倫理方面的挑戰,這些問題在 2006 年由Shinya Yamanaka發明誘導多能干細胞(iPS 細胞)后得到了很大程度的解決,他通過轉染僅四種轉錄因子將成體組織中的體細胞重編程為 iPS 細胞。對 PS 細胞的研究最初主要采用二維培養方法。當科學家開始探索三維培養技術,如球狀 iPS 細胞聚集時,發現 PS 細胞能夠自發形成更復雜的結構。基于多能干細胞(PS 細胞)的類器官模型出自Yoshiki Sasai團隊,他們構建出了類似視網膜和中樞神經系統(CNS)其他部分的結構。這些結構能夠自我組織,重現實際器官的關鍵特征,包括細胞類型多樣性和空間組織。代表各種人體組織的基于 PS 細胞的類器官生成標準化方案正在以越來越快的速度開發出來。這些方案通常需要數周或數月時間,從少量的誘導多能干細胞(iPS 細胞)開始,重點在于優化營養供應,同時模擬發育過程中信號環境的順序變化,引導 PS 細胞向目標組織分化(圖 1a)。常見的 PS 細胞衍生類器官能夠模擬腦、視網膜、肺、腎、肝和腸。

圖 1 | 多能干細胞和組織干細胞來源的人體類器官。a,誘導多能干細胞(iPS 細胞)來源的類器官生成流程。從 iPS 細胞生成類器官需要逐步進行譜系特化,模擬體內胚胎發育過程,從多能性逐步發展到目標器官。iPS 細胞通常以細胞團的形式收獲,保持細胞間接觸,并自發形成復雜結構。首先通過應用適當的微環境因子將 iPS 細胞定向誘導至特定的胚層,然后利用組織特異性發育信號進一步分化為特定器官的細胞類型。生成的類器官通常達到胎兒晚期的發育階段。圖中指出了參與胚層特化以及細胞類型特異性分化或成熟的代表性信號因子。b,組織干細胞(TSC)來源的類器官生成流程。組織被處理成單細胞或小片段,直接嵌入細胞外基質(如基質膠)中進行三維培養。由于細胞源自目標器官的活檢樣本,因此繞過了多能干細胞衍生類器官所必需的譜系定向分化。基于腫瘤干細胞的類器官培養只需要一些因子來支持其長期的增殖,因此通常需要更少的時間來建立。在 TSC 衍生的類器官中,功能性細胞類型的分化可以自發地與干細胞的自我更新同時發生,也可以通過使用細胞類型特異性微環境因子進一步誘導。TSC 衍生的類器官可以從含有活躍干細胞的組織(如消化道)中高效建立,而非自我更新的組織(如腦、視網膜、心肌)只能從誘導多能干細胞(iPS 細胞)中生成。疾病相關的基因突變可以通過基于 CRISPR 的基因編輯引入類器官模型。這一過程需要編輯后的細胞具有高度的增殖能力,以支持其從單個細胞生長,因此基因編輯通常在 iPS 細胞或 TSC 中進行,然后再進行譜系特性分化和細胞分化。ALK:間變性淋巴瘤激酶;BMP:骨形態發生蛋白;EGF:表皮生長因子;FGF:成纖維細胞生長因子;HGF:肝細胞生長因子;HHi:刺猬抑制劑;IGF:胰島素樣生長因子;OSM:癌細胞抑制因子 M;RA:視黃酸;TGF:轉化生長因子;VEGF:血管內皮生長因子;VitC:維生素 C。

實際上,幾乎每個器官都有通過其組織干細胞(TSCs)來替換受損或老化細胞的能力,除了心臟肌肉、腎小球以及中樞神經系統的大部分區域。骨髓中的造血干細胞是ZUI早被發現的組織干細胞。后來,在皮膚、角膜和腸黏膜等組織中也發現了上皮組織干細胞。2009 年,我們證明了單個來自腸上皮的組織干細胞能夠不斷增殖,生成包含所有相關細胞類型的腸類器官,展示了組織干細胞及其子代細胞固有的自我組織能力。與誘導多能干細胞類似,特定的生長因子和細胞外基質成分對于引導組織干細胞的擴增和分化成所需的各類細胞至關重要(圖 1b)。與基于多能干細胞的方法相比,基于組織干細胞的類器官是從活檢樣本或其他原代組織來源建立的(而非基于誘導多能干細胞培養),并且不需要在體外譜系特性分化。
過去十年間,類器官研究的數量迅速增長,該技術似乎已準備好開始實現其在藥物開發方面的諸多預期。類器官為體外實驗提供了模型,能夠補充傳統的二維人類細胞系和動物模型(表 1)。如上所述,細胞系幾乎無一例外地發生了某種形式的惡性轉化,要么是因為它們源自癌癥,要么是因為它們在塑料表面的二維生長環境中經過了大量適應。實際上,移植細胞系通常會形成腫瘤,而移植類器官則會產生健康且功能正常的組織。與細胞系相比,動物模型的優勢在于能夠在整個生物體的背景下重現生物現象,但它們也有局限性:由于物種間的固有差異,許多人類疾病難以在動物身上復制。同樣,動物與人類之間的生理差異也限制了藥物安全性和有效性的準確預測。此外,由于倫理方面的考量,動物的使用正受到越來越多的監管。2022 年,美國國會通過了《食品藥品監督管理局現代化法案 2.0》,隨后又通過了《法案 3.0》,以明確在藥物研發中對動物模型的需求。最近,美國食品宣布有意逐步淘汰在單克隆抗體療法及其他藥物研發中的動物實驗。因此,監管機構正在積極探尋替代方法。
在這篇綜述中,我們概述了類器官生成和維持的方法,并強調了其在疾病建模、治療方法篩選以及藥物藥理學和毒理學評估方面的應用。我們還討論了其在個性化醫療中的潛力,即可以從患者自身細胞中衍生出類器官,從而實現個體化藥物測試。最后,我們探討了監管方面的考慮以及類器官平臺要成為藥物開發中成熟工具所必須應對的挑戰。
疾病建模
類器官已被應用于多種疾病領域,包括遺傳疾病、癌癥和傳染病(圖 2)。

圖 2 | 疾病建模中的不同類型的類器官。類器官復制了真實器官的(病理)生理特征,如大腦、腎臟、肝臟、肺和腸。與永生化細胞系相比,類器官展現出復雜的組織結構,具有區域特異性和正確的細胞極性。它們包含成熟的細胞譜系,有助于進行功能檢測。值得注意的是,類器官表達關鍵受體和細胞內成分,能夠支持病原體感染,并支持這些病原體的完整生命周期。這些獨特特征(總結于上部圖表)使類器官在疾病建模中具有重要價值,包括遺傳疾病、感染和各種癌癥。此外,通過引入諸如免疫細胞等微環境成分,類器官能夠模擬和研究炎癥性疾病,并為疾病機制和潛在治療方法提供見解。所建模的疾病示例顯示在下部圖表中。MASH,代謝功能障礙相關脂肪性肝炎;EEC,腸內分泌細胞;SARS-CoV-2,嚴重急性呼吸綜合征冠狀病毒2型。
遺傳性疾病
人類類器官似乎特別適合用于模擬遺傳疾病。它們既可以由患者的患病器官活檢樣本直接獲得(患者來源的類器官,簡稱 PDOs),也可以通過 CRISPR 基因編輯技術對從健康個體獲取的類器官進行基因編輯而獲得。
囊性纖維化(CF)是一種常染色體隱性遺傳病,由 CFTR 基因的功能缺失性突變引起。該基因編碼氯離子/碳酸氫根離子通道囊性纖維化跨膜傳導調節因子(CFTR),其對于包括肺和腸道在內的多種上皮組織的離子和體液平衡至關重要。已開發出幾種 CFTR 調節劑,例如 Orkambi,它由兩種化合物(依伐卡托和盧馬卡托)組成,并已研發成功特別是針對純合 CFTRΔ508 突變的患者,這類患者約占囊性纖維化患者總數的 50%。即使攜帶相同的基因突變,患者對這種藥物的反應也各不相同,因為 CFTR 調節劑的活性會受到細胞和遺傳背景的影響。值得注意的是,人類和現有的小鼠模型在遺傳基礎和由此產生的囊性纖維化癥狀方面也存在很大差異。攜帶 Cftr 突變(包括 CftrΔ508 )的小鼠不會出現囊性纖維化患者所觀察到的嚴重氣道疾病,如黏液積聚、氣道阻塞或慢性肺部感染。囊性纖維化是首SHOU個借助 PDO 實現個性化醫療方法的疾病。
CFTR 通道由 cAMP 激活。在健康的腸道或呼吸道類器官中,加入福司可林(一種通過刺激腺苷酸環化酶將 ATP 轉化為 cAMP 從而提高 cAMP 水平的化合物)會引發快速腫脹,這是由于 CFTR 介導的水流入腔內所致。相比之下,來自囊性纖維化患者的組織類器官對福司可林無反應,不會出現腫脹。這種腫脹失敗可通過基于 CRISPR 的 CFTR 突變校正 44 或使用有效的 CFTR 調節劑來挽救。重要的是,在這種腫脹測定中測量的藥物反應與患者的臨床結果(如一秒用力呼氣容積占預計值百分比(ppFEV1)和痰細胞計數(SCC))密切相關。組織類器官腫脹測定的簡單性也使其適用于藥物高通量篩選。
原發性纖毛運動障礙(PCD)是一種影響呼吸道的遺傳性疾病,由與纖毛結構相關的基因突變引起,包括 DNAH5/11、DNAI1 和 CCDC39/40 等基因。利用原發性纖毛運動障礙患者的鼻腔氣道類器官可以對其進行研究。這些類器官能夠通過電子顯微鏡成像直接觀察到纖毛的擺動情況以及結構變化。在該類器官模型中,基因治療的潛力已得到證實。
通過先導編輯技術對 DNAH11 基因的突變進行校正。由 SFTPB(編碼肺表面活性物質相關蛋白 B)和 SFTPC 等基因突變引起的表面活性蛋白缺乏會導致家族性肺纖維化。肺泡Ⅱ型(AT2)細胞產生的表面活性蛋白可降低肺泡氣液界面的表面張力,從而防止呼吸時肺泡塌陷(肺不張),有助于肺部更輕松地擴張和高效地進行氣體交換。最近,有報道稱從胎兒肺中分離出的 AT2 細胞類器官,而源自 SFTPB 缺陷患者誘導多能干細胞(iPS 細胞)的肺類器官重現了特征性的異常板層小體形成,通過重新表達野生型 SFTPB 可以挽救這一缺陷。
腎臟疾病也可以通過類器官進行建模。多囊腎病(PKD)是見的遺傳性腎病,研究人員利用攜帶 PKD1 或 PKD2 基因突變的患者的腎臟類器官對其進行了研究,PKD1 和 PKD2 分別編碼多囊蛋白 1 和多囊蛋白 2。這些類器官重現了常染色體顯性多囊腎病(ADPKD)的標志性特征——囊腫形成,同時也表達了 ADPKD 的基因特征。利用可擴展的 ADPKD 類器官進行高通量篩選,已發現了一些有望抑制囊腫生長的化合物,其中包括喹唑啉,這是一種潛在的核因子-κB(NF-κB)通路調節劑。最近,研究人員利用攜帶 PKHD1 基因突變的誘導多能干細胞(iPS 細胞)衍生的腎臟類器官建立了一個器官芯片平臺(見方框 1 和圖 3a),PKHD1 編碼纖維囊蛋白。該系統模擬了天然組織微環境中的流體流動,并重現了常染色體隱性多囊腎病(ARPKD)患者的囊腫形成過程,為藥物測試提供了具有臨床相關性的表型。
方框1 | 類器官的演變
目前大多數類器官模型缺乏諸如血管、免疫細胞和神經支配等關鍵組織成分,而這些成分對于重現人體組織的完整生理環境至關重要。研究人員已開始通過將類器官與內皮細胞共培養(“3D 生物打印"或“微工程組裝體")或使用微流控系統(“芯片上的類器官")來構建血管網絡,從而在類器官模型中創建血液流動通道(圖 3)。例如,在肝類器官中加入人類內皮細胞可形成功能性的類似血管結構,從而改善組織功能并模擬肝臟的自然灌注。同樣,類器官中缺乏免疫細胞的問題也已通過將免疫細胞群(如巨噬細胞、樹突狀細胞和T細胞)引入類器官培養中得以解決。在癌癥研究中,一種常用的方法是將患者來源的免疫細胞整合到腫瘤類器官中,這使得能夠研究腫瘤微環境中的免疫反應,并測試免疫調節療法。最后,類器官缺乏神經支配的問題已通過將類器官與神經元共培養或加入神經祖細胞以構建神經類器官的方式得到了部分解決。
對于相對均質的不依賴三維結構的類器官,將類器官細胞以二維單層形式培養是一種可行的替代方案。起始細胞團通常在三維培養中生成。二維培養方法可降低孔間差異,提高檢測的一致性和可重復性。平鋪的單層結構還支持快速和高內涵成像,并便于整合到復雜系統中,例如“器官芯片"(organoid-on-a-chip)技術,用于研究存在基質細胞類型(包括內皮細胞和免疫細胞)時藥物的效果。我們最近描述了一種細菌蛋白——耶爾森氏菌侵襲素,它可以涂覆在二維轉孔板上,替代基質膠。值得注意的是,二維轉孔板系統還能改進藥物安全性及代謝測試,這可能需要同時接觸類器官的頂面和基底側。
遺傳性肝病。α1-抗胰蛋白酶缺乏癥(AATD)是一種由 SERPINA1 基因突變引起的單基因疾病,導致α1-抗胰蛋白酶(A1AT)水平降低。A1AT 主要在肝臟中產生,是一種絲氨酸蛋白酶抑制劑,可保護肺組織免受中性粒細胞彈性蛋白酶介導的破壞。AATD 患者肺部和肝臟受損的風險增加,從 AATD 患者體內獲取的肝類器官模型表現出疾病特征,包括 A1AT 聚集、蛋白質分泌減少以及彈性蛋白酶抑制功能受損。該模型為探索基因治療及其他旨在防止 A1AT 在肝細胞內聚合和聚集的策略提供了機會。
從 JAG1 突變型阿萊吉爾綜合征患者體內生成的類器官顯示出膽管細胞分化延遲以及管腔內細胞凋亡增加,這反映了體內膽管樹的異常情況。由 ATP7B 基因(編碼 ATP 銅轉運酶β)突變引起的威爾遜病患者的膽管細胞類器官對銅處理表現出更高的敏感性,這是由于銅轉運缺陷和細胞內銅的毒性積累所致。盡管 Atp7b 基因敲除小鼠模型能夠捕捉到該疾病的一些肝臟特征,如銅過載、炎癥和纖維化,但它無法重現患者出現的神經和精神癥狀。從膽道閉鎖患者體內獲取的肝類器官表現出異常形態,其特征為多發性空泡、增殖能力下降、頂基極組織結構紊亂以及 CFTR 蛋白水平降低。這些表型與患者膽管阻塞性疾病的表現一致,轉錄組分析進一步揭示膽管周圍存在淀粉樣β蛋白沉積,這是該疾病的一個新的病理和診斷特征。
中樞神經系統遺傳疾病。帕金森病(PD)的特征是中腦多巴胺神經元的喪失,從而導致運動和非運動癥狀。由于誘導多能干細胞(iPS 細胞)來源的多巴胺能神經元處于胎兒成熟階段,因此使用類器官模擬帕金森病的神經退行性表型以及其他通常發病較晚的中樞神經系統疾病仍具有挑戰性。因此,大多數研究都集中在使用攜帶疾病相關突變的類器官來重現早期病理過程,這可以揭示突變特異性的疾病機制。例如,攜帶 DNAJC6 功能缺失突變的人類胚胎干細胞衍生的中腦類器官(該基因與帕金森病的早發有關)表現出多巴胺神經元發育受損、病理性的α-突觸核蛋白聚集、內在神經元放電頻率增加以及線粒體和溶酶體功能障礙,這是由于 WNT-LMX1A 信號傳導受損所致。值得注意的是,Dnajc6 基因敲除小鼠并不能重現帕金森病相關的表型。同樣,攜帶帕金森病相關富亮氨酸重復絲氨酸/蘇氨酸蛋白激酶 2(LRRK2)G2019S 突變的誘導多能干細胞(細胞)來源的中腦類器官重現了患者身上觀察到的特征,包括α-突觸核蛋白聚集增加和清除受損。進一步分析發現 TXNIP 是 LRRK2 相關帕金森病的關鍵因素。
在另一個涉及常見神經退行性疾病的例子中,載脂蛋白 E 變體 APOE4 是阿爾茨海默病(AD)ZUI強的遺傳風險因素。攜帶 APOE4 變體的誘導多能干細胞(iPS 細胞)來源的大腦類器官顯示出增強的 AD 病理特征,包括 Aβ 和磷酸化 tau 水平升高、細胞凋亡以及突觸完整性降低。值得注意的是,除了 APOE4 變體對神經元的直接影響外,一種包含神經元、星形膠質細胞和小膠質細胞的共培養類器官模型揭示了小膠質細胞 APOE4 在 AD 病理中的作用,即通過誘導神經元炎癥發揮作用。進一步的轉錄分析還確定了與 APOE4 變體相關的細胞類型特異性變化,包括神經元突觸功能受損、星形膠質細胞 Aβ 攝取減少和膽固醇積累,以及小膠質細胞樣細胞形態改變和 Aβ 吞噬作用降低。源自家族性阿爾茨海默病(攜帶編碼淀粉樣蛋白前體蛋白的 APP 基因重復或編碼早老素 1 或 2 的 PSEN1 或 PSEN2 基因突變)患者的誘導多能干細胞(iPS 細胞)所衍生的類器官會自發形成病理變化,例如淀粉樣蛋白聚集、過度磷酸化的 tau 蛋白以及內體異常,而這些病理變化可通過β-和γ-分泌酶抑制劑得以緩解。
盡管過度磷酸化的 tau 蛋白是阿爾茨海默病(AD)的一個標志,但編碼 tau 蛋白的 MAPT 基因的突變可導致額顳葉癡呆(FTD),這是一種異質性疾病,其特征為 tau 蛋白聚集以及谷氨酸能皮質神經元的丟失。攜帶 MAPT 突變(R406W)的誘導多能干細胞(iPS 細胞)來源的大腦類器官已被用于研究 tau 蛋白病的特定機制。R406W 突變通過破壞微管的穩定性導致 tau 蛋白錯位和軸突,這也會擾亂突變神經元中的線粒體運輸。突變的 tau 蛋白磷酸化程度降低,更容易受到鈣蛋白酶介導的切割和片段化。同樣,攜帶另一種 MAPT 突變(V337M)的類器官已被用于研究早期 FTD 的發病機制。這些類器官在多個時間點進行表型評估,以確定 FTD-tau 病理發展的各個階段。在較晚階段(4 個月后),觀察到 FTD 的特征,包括神經元丟失、tau 蛋白的逐漸積累以及對谷氨酸毒性的易感性。tau 蛋白的積累主要是由于蛋白水解活性缺陷所致,這是由自噬 - 溶酶體途徑的破壞引起的,而非 tau 蛋白表達增加。進一步的基因富集分析顯示,編碼神經元 RNA 結合蛋白的剪接調節基因 ELAVL4 表達增加,導致剪接失調和興奮性神經元功能受損。這種興奮性神經元發育的失調會導致興奮毒性——即興奮性神經遞質(主要是谷氨酸)過度刺激,導致鈣離子大量涌入神經元,造成細胞功能障礙,最終導致細胞死亡——以及在發育后期出現細胞凋亡。此外,通過使用脂質激酶抑制劑阿匹莫德(apilimod)可以挽救突變型 tau組織類器官中谷氨酸能神經元的丟失,該抑制劑可阻止谷氨酸受體再循環至膜上,從而減少谷氨酸誘導的興奮毒性。另一種方法是使用腺相關病毒(AAV)將突變型 tau(P301L)注射到誘導多能干細胞(iPS)來源的前腦類器官中,也能誘導出含有 tau 原纖維的明顯 tau 聚集體。除了 MAPT 基因突變外,額顳葉癡呆(FTD)還有多種其他遺傳原因,包括導致顆粒蛋白前體蛋白單倍體不足的 GRN 基因突變以及 C9ORF72 基因中的 GGGGCC 重復擴增。由誘導多能干細胞(iPS 細胞)衍生的腦類器官切片模型重現了皮質結構,并表現出 C9ORF72 相關 FTD 的早期分子病理學特征。在這些類器官中,星形膠質細胞中自噬相關蛋白 P62 的水平升高,深層神經元則積累二肽重復蛋白聚(GA)、出現 DNA 損傷并發生核固縮,這些病理變化可通過藥物 GSK2606414 得到緩解(參考文獻 71)。具有 C9ORF72 擴增的 iPS 細胞衍生的 FTD 類器官還表現出 TDP43 功能障礙加劇,這是急性損傷的關鍵驅動因素。基于 FTD 類器官的 CRISPR 干擾(CRISPRi)篩選已確定 KCNJ2 抑制為減輕神經退行性過程的有前景的治療靶點。
神經發育障礙也可以在類器官中建模。脆性 X 綜合征(FXS)是由脆性 X 智力低下蛋白(FMRP)的缺失引起的,這是一種 RNA 結合蛋白,可調節參與突觸發育和可塑性的特定 mRNA 的翻譯,包括腦源性的神經生長因子(BDNF)、代謝型谷氨酸受體(mGluRs)、鈣/鈣調蛋白依賴性蛋白激酶 II(CaMKII)和突觸后致密蛋白 95(PSD95)。在來自脆性 X 綜合征患者前腦的類器官中,FMRP 的缺失會導致神經發生、神經元成熟和興奮性失調。通過抑制磷脂酰肌醇 3-激酶(PI3K)通路可以挽救這些缺陷,但使用 mGluR5 拮抗劑則無效。值得注意的是,針對 mGluR5 的療法在臨床試驗中效果有限,但在動物模型中卻顯示出有希望的結果。對這些脆性 X 綜合征類器官的轉錄組分析進一步揭示了人類 FMRP mRNA 的靶點,如 CDH2,為脆性 X 綜合征的治療開發提供了機制見解和潛在的可藥物靶點。該模型的一個顯著局限性在于脆性 X 綜合征類器官中 GABA 能抑制性神經元的顯著減少。因此,進一步研究 FMRP 缺失對 GABA 能神經元發育的影響,將受益于富含 GABA 能神經元的另一種模型系統,如腹側前腦類器官。此外,這種脆性 X 綜合征(FXS)類器官模型無法捕捉細胞類型的多樣性及其復雜的相互作用,尤其是涉及星形膠質細胞的相互作用,據報道星形膠質細胞可介導人類脆性 X 綜合征神經元異常放電的非自主性校正。最近的一項研究表明,脆性 X 綜合征相關蛋白(FMRP)能夠抑制由 YTH 結構域含蛋白 1(YTHDF1)介導的神經元翻譯。在誘導多能干細胞(iPS 細胞)來源的前腦類器官模型中,一種針對 YTHDF1 的小分子抑制劑逆轉了脆性 X 綜合征相關蛋白缺乏所導致的發育缺陷。
代謝紊亂
代謝功能障礙相關脂肪性肝炎(MASH)是一種肝臟疾病,其特征是肝細胞內脂質堆積引發慢性炎癥和纖維化,全QUAN球約有 5% 的成年人受其影響。MASH 的風險因素包括營養過剩,或者更罕見的遺傳性脂質代謝紊亂。由基因改變(如瘦素或瘦素受體突變,或與脂質代謝相關的基因如 Apoa5、Nr1h4、Pparg、Cebpa 的敲除)或飲食因素(高脂飲食、西式飲食或過量糖分攝入)驅動的 MASH 動物模型被廣泛使用。然而,這些動物模型并不適合大規模藥物篩選,而且物種間的差異也使得研究結果難以直接應用于人類生理學。
肝類器官代表了肝臟組織的三維結構,并重現了原代肝細胞的基因表達譜和細胞功能。源自患者的 MASH 類器官80 或由代謝物刺激誘導的 MASH 類器官81 捕獲了疾病的關鍵特征,其特征為促炎通路和腫瘤相關標志物的上調、脂質積累增加以及對細胞凋亡的敏感性增強。例如,一種在游離脂肪酸(FFA)處理后出現脂質積累的肝類器官系統已被用于研究二甲雙胍和左旋肉堿的作用,這兩種藥物均用于治療 2 型糖尿病(T2D)82。源自沃爾曼病患者的肝類器官——該病由溶酶體酸性脂肪酶(LAL)的遺傳功能障礙導致甘油三酯水解受損引起——表現出大量脂質積累和嚴重的脂肪性肝炎。這些表型可通過使用成纖維細胞生長因子 19(FGF19)治療得到緩解,FGF19 可激活法尼醇 X 受體(FXR)以降低脂質儲存誘導的活性氧(ROS)活性83。其他化合物也在肝臟相關類器官模型中進行了評估,結果喜憂參半。盡管有報道稱鎂能改善 2 型糖尿病和肝臟代謝紊亂,但在 3D 器官模型中,鎂對逆轉疾病表型無效。相比之下,索拉非尼是一種臨床上用于治療肝癌和腎癌的廣譜酪氨酸激酶抑制劑,在 3D 共培養模型中顯示出減少脂肪變性誘導的纖維化生成的潛力。
值得注意的是,脂肪性肝炎相關肝纖維化(MASH)中炎癥變化與纖維化進展之間的相互作用涉及庫普弗細胞(KCs)和肝星狀細胞(HSCs)的相互影響。源自誘導多能干細胞(iPS 細胞)的多細胞類型肝類器官已被用于研究 MASH 的發病機制并促進藥物篩選。在此系統中,游離脂肪酸(FFAs)可刺激前膠原蛋白的生成。長期的脂肪酸暴露會導致庫普弗細胞中炎癥細胞因子表達增加、肝星狀細胞活化以及類器官硬度升高。這些發現強調了生成多譜系相互作用對于改進 MASH 模型的重要性。
類器官不僅能夠模擬代謝疾病,還促進了新療法的發現。來自家族性高膽固醇血癥患者的誘導多能干細胞(iPS)來源的肝細胞揭示了強心苷在降低載脂蛋白 B 生成方面的作用。來自線粒體 DNA 缺乏綜合征患者的肝細胞表明,NAD 治療可改善線粒體功能,通過激活過氧化物酶體增殖物激活受體γ共激活因子 1α(PGC1α)來恢復 ATP 水平。肝細胞類器官對于篩選小分子藥物具有重要價值。
在與臨床前代謝功能障礙相關脂肪性肝病(MASLD)和 MASH 相關的背景下,我們研究了抑制劑或基于 CRISPR 的功能研究。我們使用胎兒肝細胞類器官來模擬 MASLD 的早期發病情況,分別在遺傳性脂肪變性(分別編碼載脂蛋白 B 和微粒體甘油三酯轉運蛋白的基因)或游離脂肪酸過載的情況下。作為概念驗證,常規藥物篩選和 CRISPR 介導的失活篩選均可在這些 MASLD 類器官中進行,突出了 FADS2(編碼脂肪酸去飽和酶 2)是肝脂肪變性的一個決定因素。
慢性炎癥性疾病
對諸如炎癥性腸病(IBD)或乳糜瀉(CeD)等免疫介導性疾病的建模,需要將類器官與適當的免疫細胞(見方框 1)和/或炎癥介質相結合。通過基因組和轉錄組分析,已確定了眾多與炎癥性腸病(IBD)相關的風險因素。然而,在動物模型中闡明這些因素的主要細胞靶點及潛在機制卻頗具挑戰性。源自 IBD 患者93 或暴露于促炎細胞因子的類器官為相關研究提供了便利。例如,對白細胞介素-22刺激的結腸類器官進行分析,發現招募 C-X-C 趨化因子受體 2 (CXCR2)+ 中性粒細胞的基因表達上調。值得注意的是,源自 IBD 炎癥黏膜的類器官保留了炎癥組織的轉錄特征,而且兒童 IBD 患者的疾病特異性表觀遺傳改變在移除炎癥環境后仍可在類器官中持續存在。一種具有生理相關性的研究炎癥性腸病(IBD)發病機制的一種方法涉及類器官與免疫細胞共培養系統。

圖 3 | 疾病建模和藥物安全性評估中的類器官系統。a,物質遞送和擴散方式。病原體受體和化合物轉運蛋白或通道可在細胞頂面不對稱分布。傳統類器官通常嵌入基質膠中,其基底側暴露在外(頂面朝內),需要將病原體或化合物微注射到類器官腔內以提高遞送效率。通過去除基質膠生成的翻轉(頂面朝外)類器官,可減輕遞送和擴散方面的挑戰,同時保持類器官的三維結構。在二維 Transwell 培養中,類器官細胞的頂面和基底側均接觸環境培養液,從而能夠與外部環境進行物質交流。與 Transwell 系統類似,生物工程化的微流控平臺通過入口和出口,能夠從類器官細胞的頂面和基底側精確控制物質遞送。 b,具有改進的組織級復雜性和組織結構的類器官模型。在無基質膠的懸浮培養系統中,不同類型的細胞混合物可以自發聚集形成組裝體,其細胞外基質由內皮細胞和基質細胞等不同類型的細胞提供。盡管組裝體顯著提高了細胞的復雜性,但它們仍無法準確反映組織的組織結構。生物打印的類器官展現出不同細胞譜系的排列,與天然組織的結構極為相似,即具有更完善的血管網絡、神經支配模式和分區。當在生物工程芯片上培養時,不同類型的細胞(如內皮細胞、基質細胞或免疫細胞)可以通過定制設計系統地整合和組織,以實現復雜的組織級結構。
例如,克羅恩病患者的自身黏膜 T 細胞能夠浸潤類器官并直接誘導上皮細胞死亡。這種浸潤和細胞毒性取決于 T 細胞通過 CD103(一種介導 T 細胞與上皮細胞黏附的整合素)和 NKG2D(一種與上皮細胞應激誘導配體結合的激活受體)進行識別。針對 CD103 和 NKG2D 的阻斷抗體可靶向免疫細胞與上皮細胞的相互作用,從而減少 T 細胞浸潤和上皮損傷。乳糜瀉是一種由麩質引發的自身免疫性疾病,與特定的 HLA-DQ 單倍型相關。小鼠自身并不具備這些人類的 HLA 單倍型,盡管已開發出表達人類 HLA 分子的轉基因小鼠,但它們并不能完WAN全復制乳糜瀉的免疫反應或疾病病理,或者需要人工誘導或基因改造,而這并不能完WAN全模擬自然疾病過程。乳糜瀉患者的十二指腸活檢樣本可以直接在氣液界面系統中培養(圖 3a),該系統能保留腸道上皮以及多種組織駐留免疫細胞群,從而再現麩質依賴性病理。利用這種共培養系統進行的功能研究表明,IL-7 是一種麩質誘導的致病調節因子,在乳糜瀉發病機制中是誘導上皮破壞的必要且充分條件。
甲狀腺是器官特異性自身免疫的著ZHU名靶點:甲狀腺功能亢進癥(格雷夫斯病)和甲狀腺功能減退癥(橋本甲狀腺炎)是自身免疫性疾病,其特征是激素分泌異常。103 可以很容易地生成含有激素分泌細胞的甲狀腺類器官。格雷夫斯病自身抗體(已知可激活促甲狀腺激素受體 TSHR)作用下的甲狀腺類器官表現出細胞增殖增加和激素分泌增多,重現了關鍵的疾病特征。104 橋本甲狀腺炎患者的類器官中趨化因子 CCL2 和 CCL3 水平升高,這兩種趨化因子可能在橋本甲狀腺炎發病過程中招募免疫細胞方面發揮關鍵作用。
慢性阻塞性肺疾病(COPD)主要由肺泡和氣道受損引起,導致氣流受限、黏液分泌增多以及炎癥反應,這些因素共同導致呼吸困難。來自 COPD 患者的支氣管類器官證實存在杯狀細胞增生和纖毛擺動頻率降低的情況。通過將人類肺類器官暴露于香煙煙霧提取物中,對吸煙相關的 COPD 進行了研究,結果表明與健康氣道類器官相比,香煙煙霧會抑制類器官的形成,并增加肺泡類器官對香煙煙霧的敏感性。
傳染病
微孢子蟲(Cryptosporidium parvum)是一種能引發腹瀉的原生動物寄生蟲,其生活周期復雜,包含無性生殖和有性生殖階段,且一直難以在實驗室中培養。人類腸道類器官,尤其是分化出的腸上皮細胞,能夠支持微孢子蟲生活周期中的無性和有性階段,并能產生具有與從感染宿主動物體內獲取的卵囊相當的二次感染能力的卵囊。同樣,人類腸道類器官為人類諾如病毒(HuNoV)提供了體外感染平臺,確定了腸上皮細胞是其復制的目標細胞109。HuNoV 感染是急性胃腸炎的主要病因,但傳統細胞系無法支持 HuNoV 的感染和復制,而且由于病毒受體和免疫反應的物種特異性差異,小鼠對感染具有天然抵抗力。此外,小鼠諾如病毒模型在病毒結構、受體使用和致病性方面與 HuNoV 存在差異,這限制了研究結果直接應用于人類疾病。腸道類器官克服了這些障礙,表現出對血型抗原的 HuNoV 結合特異性,這與動物和人類研究的結果一致。除了 HuNoV 之外,腸道類器官還被用于模擬其他腸道病毒的感染,包括輪狀病毒、柯薩奇 B 病毒和腸道病毒。
2016 年,世界衛生組織宣布寨卡病毒(ZIKV)感染與巴西新生兒小頭畸形及其他神經系統疾病群發事件構成國際關注的突發公共衛生事件。由于無法獲取活體感染的人類胎兒組織,對寨卡病毒在發育中的中樞神經系統中的發病機制了解有限。小頭畸形的表型需要一個三維結構模型,這只能通過感染腦類器官來實現。使用人類誘導多能干細胞(iPS 細胞)衍生的腦類器官進行的實驗表明,寨卡病毒感染會破壞大腦皮質層,減少細胞增殖,并降低功能性神經元的數量。在旋轉生物反應器中培養的特定區域腦類器官表明,亞洲和非洲的寨卡病毒株均優先且高效地感染神經前體細胞,引發過早分化和細胞死亡增加,這與在人類胎兒中觀察到的感染模式一致。腦室區和室管膜下區的前體細胞均可能受到影響,這支持了在人類神經發育過程中增殖的前體細胞是該疾病關鍵靶點的假設。基于這些類器官模型的機制研究揭示,寨卡病毒蛋白 NS2A 會損害人腦前腦類器官中放射狀膠質細胞的增殖,并破壞神經干細胞的頂連接形成。寨卡病毒蛋白 NS4A 和 NS4B 的表達會抑制 AKT-mTOR 信號傳導,從而阻礙神經發生并促進自噬。寨卡病毒蛋白 NS5 特異性靶向人類而非小鼠的 STAT2,以抑制 I 型干擾素信號傳導。寨卡病毒還能激活 Toll 樣受體 3(TLR3)介導的先天免疫反應,導致參與神經發生、軸突導向和細胞凋亡的基因失調。人腦前腦類器官也被用于藥物篩選,發現溴化海罌SU堿能消除感染寨卡病毒的人類神經祖細胞中的寨卡病毒,并能挽救寨卡病毒誘導的小頭畸形表型。另一項藥物再利用篩選發現,泛半胱天冬酶抑制劑艾米卡司能抑制寨卡病毒誘導的半胱天冬酶 3 活性,從而保護類器官培養中的人類皮質神經祖細胞,而美國食品批準的 B 類驅蟲藥氯LV硝柳胺能阻斷寨卡病毒的復制。此外,寨卡病毒(ZIKV)感染通過病毒 NS3 蛋白與鈣/鈣調蛋白依賴性蛋白激酶 II(CaMKII)的相互作用,增加宿主細胞中瞬時受體電位通道 4(TRPC4)的表達,從而增強 TRPC4 介導的鈣內流。藥理學上抑制 CaMKII 或 TRPC4 有可能減少癲癇發作,并阻止寨卡病毒在誘導多能干細胞(iPS 細胞)來源的腦類器官中的傳播。
呼吸道感染。呼吸道是病原體的主要攻擊目標,2019 冠狀病毒病大流行促使對體外模型的需求高漲。在分化的人氣道類器官中,表達血管緊張素轉化酶 2(ACE2)和跨膜絲氨酸蛋白酶 2(TMPRSS2)的氣道纖毛細胞是初始感染的主要細胞靶點。鑒于 ACE2 和 TMPRSS2 在多種上皮組織中均有表達,嚴重急性呼吸綜合征冠狀病毒 2 型(SARS-CoV-2)能夠感染多種上皮細胞。(SARS-CoV-2)在呼吸道初次感染后可傳播至其他器官。含有表達 ACE2 的腸上皮細胞的人類腸道類器官能夠支持 SARS-CoV-2 的強效感染和復制。后續研究利用 CRISPR 基因編輯技術構建的類器官生物庫表明,SARS-CoV-2 以及中東呼吸綜合征冠狀病毒(MERS-CoV)和 SARS-CoV 特別依賴 TMPRSS2,該蛋白酶可激活刺突蛋白,使病毒包膜直接與宿主細胞膜融合。因此,這些病毒無需通過內吞作用即可感染宿主細胞,這使得 TMPRSS2 成為廣譜冠狀病毒治療藥物的一個有吸引力的靶點。值得注意的是,(羥)氯LV喹是一種內吞作用阻滯劑,最初基于細胞系研究而被提出,并被廣泛用于治療FEI炎患者。然而,該藥物在類器官模型中并不能抑制病毒復制。這一發現與臨床觀察結果一致,即(羥)氯LV喹對 SARS-CoV-2 無效,這突顯了類器官作為篩選新型藥物治療手段的更準確的轉化平臺的潛力。
更廣泛地說,氣道類器官可用于研究諸如甲型流感病毒(IAV)、呼吸道合胞病毒(RSV)或人類鼻病毒 C(HRV-C)等呼吸道病毒的感染動態和跨物種傳播潛力。它們表達 TMPRSS2 和 TMPRSS4,這兩種蛋白可介導 IAV 表面血凝素的切割,從而促進病毒與宿主細胞膜的融合。分化后的二維類器官(見方框 1,另見圖 3a)能夠區分人類感染性 IAV 與感染性較弱的禽QIN流感和豬流感亞型的復制能力,并已被用于評估近期禽QIN流感 H5N6 和 H5N8 株的溢出風險。長期可擴增的人類氣道類器官還能重現 RSV 感染的關鍵特征,包括由病毒非結構蛋白 NS2 驅動的細胞運動性增強以及共培養期間中性粒細胞的優先募集。同樣,它們能夠維持 HRV-C 的可重復傳播,從而為病毒與宿主的相互作用提供見解。在 HRV-C 感染后,氣道類器官比鼻類器官引發更強的先天免疫反應,使用α-CDHR3 和抗病毒DU藥物治療可顯著抑制病毒生長,這表明其具有作為抗病毒DU藥物開發平臺的潛力。
癌癥
許多癌癥類型,如胰腺癌、肝癌和乳腺癌,在動物模型中不會自發形成。即便通過引入特定的癌癥突變來實驗性地誘導腫瘤(這通常需要相當長的時間),這些模型仍無法模擬人類癌癥的復雜性和異質性,包括其遺傳多樣性和免疫環境。在過去十年中,患者來源的腫瘤類器官(PDTOs)的出現極大地豐富了癌癥的臨床前模型庫。這些培養物幾乎可以從所有癌組織中建立,起始材料可以是活檢或切除的組織。它們具有可擴展性,并且能很好地重現原始腫瘤的組織學、遺傳學和轉錄組學特征,還能穩定地移植到小鼠體內進行體內表征。攜帶特定基因突變的 PDTO 可以在不依賴于通過突變激活的致癌途徑所傳遞的生長因子的情況下獨立生長。例如,具有 KRASG12V 突變的類器官可以在缺乏表皮生長因子(EGF)的情況下生長,而 EGF 對健康類器官的生長是必BI不BU可KY少SHAO的,這是區分腫瘤衍生的生長與正常組織生長的常用方法。腫瘤類器官的實用性在藥物測試研究中得到了進一步證明,這些研究表明了突變特異性的細胞毒性作用。例如,對不可逆的 ERBB 受體酪氨酸激酶家族抑制劑阿法替尼的敏感性與乳腺癌類器官中的 HER2 表達水平相關。同樣,具有 BRCA1/2 突變特征的類器官對聚(ADP - 核糖)聚合酶(PARP)抑制劑更敏感,從而導致腫瘤細胞死亡。此外,通過在野生型類器官中依次進行 CRISPR 工程改造,可以創建出具有特定致癌突變的定義明確的癌癥模型。這種人工創建的癌癥類器官在異種移植后會產生預期的組織學特征。
類器官腫瘤模型(PDTO)及其對應的健康類器官已在各種腫瘤類型的生物樣本庫中大量生成并儲存(總結于表 2 和補充表 1)。這些 PDTO 反映了腫瘤間和腫瘤內的異質性,有助于研究腫瘤的演變和進展,測試治療反應的變異性,理解耐藥機制并發現新的治療靶點。例如,MCLA-158(佩托塞單抗)是一種針對 EGFR 和 LGR5 的雙特異性抗體,其開發完WAN全基于結腸癌 PDTO 系列(見框 2)。重要的是,PDTO 對抗腫瘤療法的敏感性與其親本腫瘤組織相當,這突顯了 PDTO 在藥物篩選中的可靠性。值得注意的是,在其“初始狀態"下,PDTO 系列不包含免疫細胞、腫瘤基質或血管,但通過共培養,借助微流控系統和生物工程技術(如器官芯片和 3D 生物打印)(見框 1,另見圖 3b),這些成分可以很容易地被j加入。
盡管具有這些優勢,類器官仍是一種高度簡化的實驗平臺,盡管其結果往往穩健且可重復,但在將其常規應用于藥物開發之前,必須通過現有的體外平臺、動物研究和臨床試驗數據對其結果進行廣泛驗證。類器官腫瘤模型在多種癌癥類型的個性化醫療方面展現出前景,胰腺癌、胃腸道癌和乳腺癌中的類器官藥物反應與臨床結果之間存在相關性。然而,其更廣泛的可轉化性仍有待最終證實,目前正在進行多項隨機臨床試驗以評估其預測價值,尤其是在放療和化療環境中。重要的是,在腫瘤學之外,轉化證據仍然稀缺,且缺乏嚴格的臨床驗證。此外,很少有負面預測數據被報道,這限制了我們對基于類器官預測的局限性的理解。在神經學及其他復雜的系統性疾病中,類器官還面臨著模擬多細胞相互作用和全身藥代動力學的困難,這限制了其預測效用。
安全性評估的應用
盡管大多數研究都集中在利用類器官進行藥物療效和疾病建模方面,但其在制藥行業的應用如今正在擴展,用于評估藥物化合物在多個器官中的安全性(表 3)。
肝毒性
肝臟在藥物代謝中起著核心作用,肝毒性是導致藥物研發失敗、上市后撤市或使用受限的主要原因之一。藥物性肝損傷(DILI)是藥物治療相關的重要致病和致死原因,其預測和預防仍具有挑戰性。源自 TSCs 或 PS 細胞的肝類器官為預測藥物性肝毒性提供了很有前景的機會。
表 2 | 用于藥物篩選和評估的代表性 PDTO 生物樣本庫
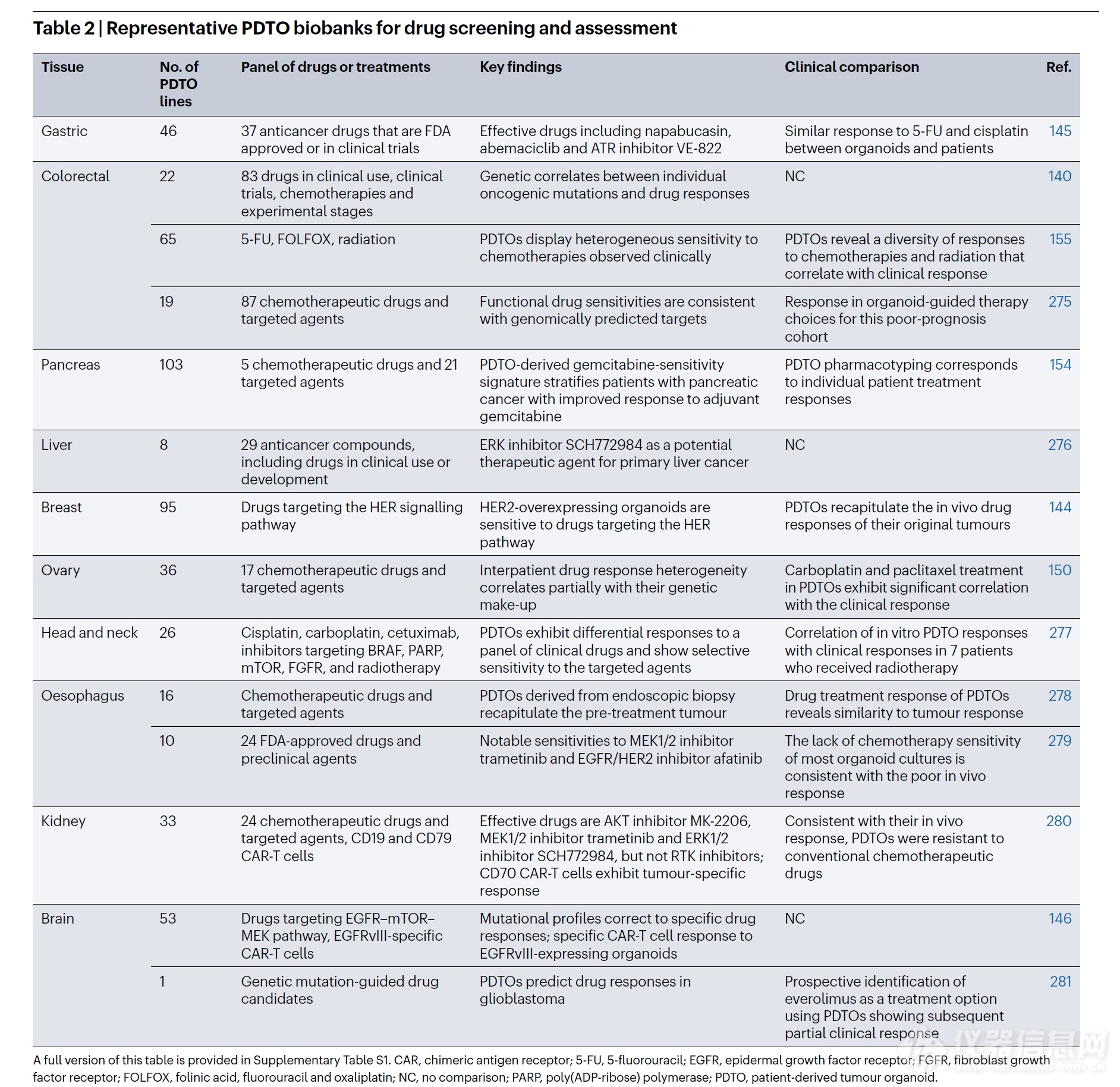
該表的完整版本見補充表 S1。CAR,嵌合抗原受體;5-FU,5-氟尿嘧啶;EGFR,表皮生長因子受體;FGFR,成纖維細胞生長因子受體;FOLFOX,亞葉酸鈣、氟尿嘧啶和奧沙利鉑;NC,無對照;PARP,聚(ADP-核糖)聚合酶;PDTO,患者來源腫瘤類器官。
來自多能干細胞的功能成熟的類肝器官(HLOs)能夠重現曲格列酮(一種因肝毒性而撤市的抗糖尿病藥物)、對乙酰氨基酚(也稱為撲熱息痛;一種廣泛使用的鎮痛藥)以及抗生素特拉氟沙星和左氧氟沙星已知的肝毒性,在臨床相關濃度下比二維肝細胞具有更高的敏感性。同樣,源自 TSC 的 HLOs 在模擬藥物誘導的磷脂沉積癥方面優于傳統的肝癌細胞系 HepG2,磷脂沉積癥是一種與多種藥物相關的嚴重不良反應,這突顯了它們評估代謝物介導的肝毒性的能力。此外,多能干細胞衍生的 HLOs 已被用于建立一種高通量檢測方法,用于大規模化合物篩選,通過多重讀出準確標注了 238 種藥物的藥物性肝損傷(DILI)潛力,并展示了其在個體供體中模擬波生坦(一種可導致膽汁淤積性肝損傷的內皮素受體拮抗劑)基因型特異性易感性的能力。基于這些進展,人體肝臟模型能夠模擬一系列藥物性肝損傷相關的表型,包括脂肪變性、纖維化和免疫反應,且使用化合物得出的結果與臨床數據高度一致。例如對乙酰氨基酚和 TAK-875(一種曾用于治療 2 型糖尿病的 G 蛋白偶聯受體 40(GPR40)激動劑,后因肝毒性而停止研發)。擴大 HLO 的應用范圍,肝內膽管細胞類器官已被用于研究氯LV丙BING嗪誘導的膽管損傷,并證明該模型能有效模擬藥物引起的膽道毒性。最近,HLO 已被用于評估腺相關病毒(AAV)載體,這種載體在基因治療中被廣泛應用,尤其是針對肝臟的治療,為基因治療開發中評估載體性能和靶向肝毒性提供了新的平臺。
腎毒性
由人類多能干細胞衍生的腎臟類器官,盡管仍缺少一些關鍵轉運蛋白和腎小管濾過功能,但能夠模擬藥物引起的急性腎損傷,這是藥物開發中的一個重大安全問題。這些類器官包含腎小球、集合管、腎間質和內皮細胞,并能自我組織成類似腎小球的結構,包括足細胞、近端小管、亨氏袢和遠端小管,進一步重現了體內腎小球的組織結構。它們在對順鉑和慶大霉素等腎毒性物質的反應中表現出不同的細胞凋亡情況,腎損傷標志物腎損傷分子 1(KIM1)的表達呈劑量依賴性上調,證明了其在腎毒性測試中的實用性。后續研究進一步完善了腎臟類器官模型,使其能更好地模擬腎毒性反應。順鉑和阿霉素誘導的損傷,包括劑量依賴性細胞凋亡,已在傳統類器官、懸浮培養的微類器官以及生物打印的腎臟類器官中得到重現,這些類器官還證明了阿霉素和氨基糖苷類抗生素的毒性。一種具備免疫功能、血管化的腎臟類器官芯片系統,結合了灌注的外周血單核細胞(PBMCs),進一步實現了對免疫介導毒性評估的能力,例如在 T 細胞雙特異性抗體(TCB)針對 HLA-A2 呈遞的 WT1 肽的響應下,對表達 WT1 的細胞進行選擇性殺傷。這突顯了該系統能夠在動態微環境中評估化學和免疫介導的毒性。
胃腸道毒性
利用類器官模型對小分子和大分子藥物的胃腸道毒性進行更準確的預測,能夠顯著改善臨床前的風險效益評估,并減少藥物研發過程中的失敗率。一項開創性的研究利用源自人類回腸的 TSC 衍生類器官來模擬藥物引起的腹瀉,建立了一種基于類器官的檢測方法,以 31 種參考藥物進行驗證。該檢測方法在預測藥物引起的腹瀉臨床發生率方面準確率達 90%。在此基礎上,利用源自 TSC 的小腸和結腸類器官探索了胃腸道毒性的分子決定因素,研究了多柔比星和吉非替尼引起的副作用機制。開發了一種經濟高效的腸道類器官培養方法,能夠對小分子進行表型高通量篩選,有助于簡化臨床前工作流程。利用這一平臺,未分化的類器官能夠準確區分具有細胞毒性或無細胞毒性的化合物。此外,將人類、大鼠和狗類器官對化合物的反應進行比較,揭示了物種特異性的敏感性差異,這與臨床前研究結果一致,并證明了類器官在早期安全性評估中的實用性。腸道類器官平臺的預測能力還延伸到了對諸如 TCB 等基于蛋白質的生物制劑的“靶向腫瘤外"效應的評估,包括缺乏交叉反應的臨床前物種。補充了免疫細胞的腸道 PDO 和腫瘤類器官已顯示出 TCB 的組織特異性腫瘤外毒性,成功捕捉到了傳統組織模型因缺乏這些免疫成分而無法預測的臨床不良反應。在此基礎上進一步拓展,通過將上皮類器官與自體組織駐留記憶(TRM)T 細胞整合,生成了人類腸道免疫類器官,并已用于研究癌癥患者中觀察到的 TCB 引起的腸道炎癥。
中樞神經系統毒性
藥物誘導的神經毒性是候選藥物研發終止的一個主要原因,中樞神經系統不良反應被報道導致了 7%至 34%的早期和后期項目終止。類器官為揭示可能無法通過傳統方法檢測到的毒性機制提供了強大的模型。較簡單的系統,如二維細胞培養,可能會忽略依賴于中樞神經系統微環境復雜細胞相互作用的獨特毒性機制,盡管小鼠模型確實復制了中樞神經系統的部分復雜性和多樣性,但它們可能無法準確代表人類對毒素的特異性反應。例如,由于缺乏類似于人類腦組織的體外模型,長春新堿神經毒性的機制研究過去一直集中在周圍神經元上。最近,由誘導多能干細胞衍生的腦類器官揭示了長春新堿對大腦發育的神經毒性,確定了細胞外基質介導的信號傳導,并突出了基質金屬蛋白酶在這一過程中的作用。
方框2 | MCLA-158(佩托西單抗),利用專門的癌癥類器官生物樣本庫進行癌癥藥物研發
靶向亮氨酸富集重復序列含 G 蛋白偶聯受體 5(LGR5)和表皮生長因子受體(EGFR)的雙特異性抗體 MCLA-158 為類器官技術如何推動藥物研發提供了一個說服力的范例。整個發現項目均使用源自患者的結腸癌類器官系進行。生成了一個包含 500 多種雙特異性抗體的庫,其中一臂靶向 EGFR 家族成員,另一臂靶向包括 LGR5 在內的干細胞標志物。在一組較小的結直腸癌(CRC)類器官系中進行的無偏功能性篩選,以檢測生長抑制和形態變化,從而確定了 MCLA-158,隨后在更廣泛的健康和 CRC 類器官中對其進行了進一步表征。MCLA-158 能夠消除 CRC 類器官,但對健康結腸類器官無影響。
MCLA-158 在多種上皮癌的臨床前模型中已展現出治療特性,例如抑制 KRAS 突變型結直腸癌腫瘤生長、阻斷轉移啟動以及抑制腫瘤再生。其研發項目從發現到一期臨床試驗僅用了 30 個月。正在進行的臨床研究包括一線頭頸部鱗狀細胞癌(HNSCC)的 III 期注冊試驗(單藥治療 292 及與帕博利珠單抗聯合用藥 293),以及于 2024 年底啟動的轉移性結直腸癌晚期治療的 II 期開放標簽試驗。
表 3 | 類器官在藥物安全性評估中的應用
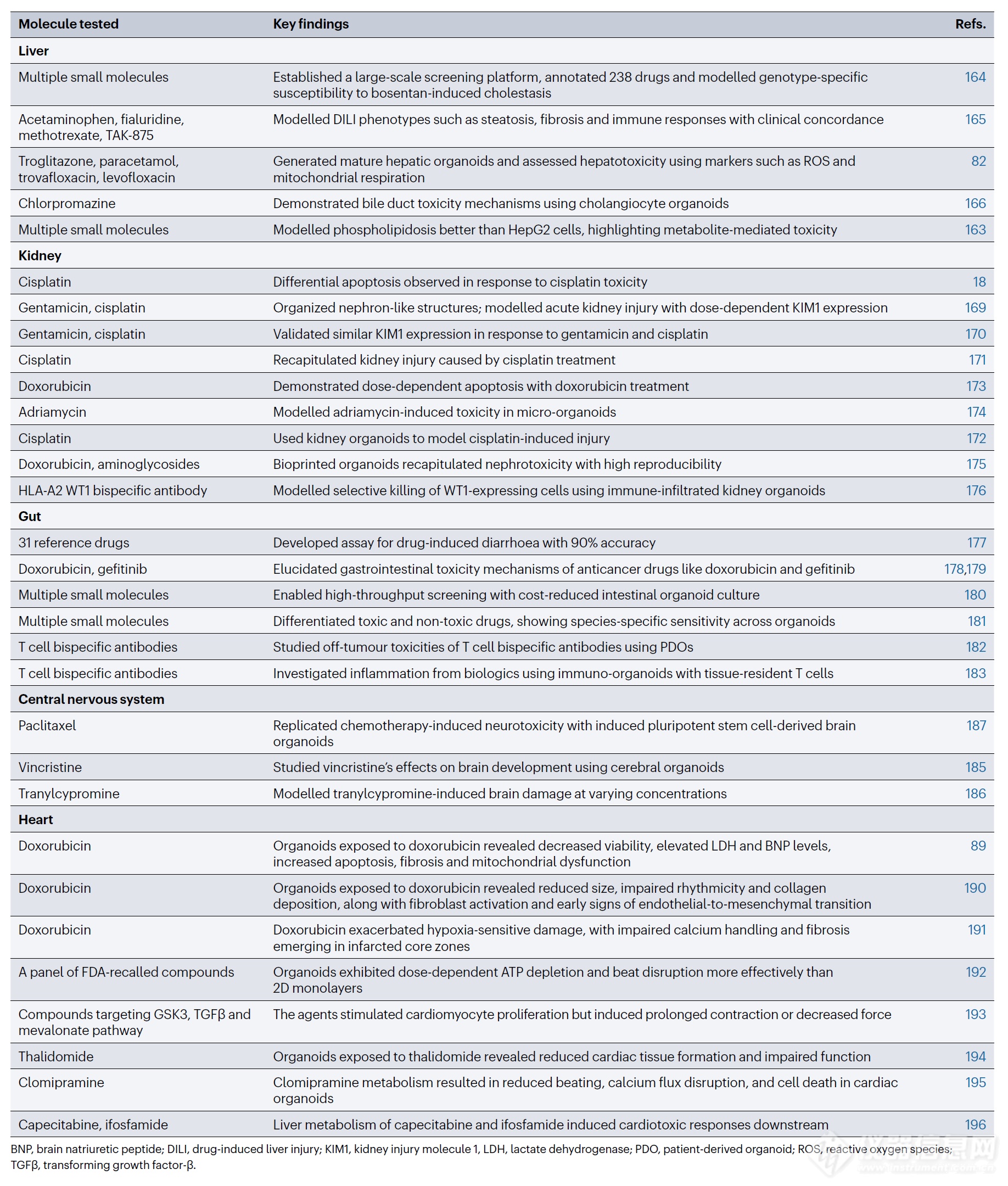
轉化生長因子 -β ,TGFβ 。 BNP,腦鈉肽;DILI,藥物性肝損傷;KIM1,腎損傷分子 1;LDH,乳酸脫氫酶;PDO,患者來源類器官;ROS,活性氧;TGFβ,轉化生長因子-β。
這些發現強調了使用復雜的三維腦類器官系統來探究可能涉及發育中的人腦組織結構和細胞復雜性的毒性機制的重要性。腦類器官可以在較長時間內培養,以實現功能成熟。成熟的腦類器官已被用于研究曲唑酮(一種用于治療難治性抑郁癥的藥物)對大腦發育的影響,通過轉錄抑制 BHC110/LSD1 目標基因和組蛋白 H3 賴氨酸 4 去甲基化,發現其對神經元和星形膠質細胞存在劑量依賴性的腦損傷。最近,誘導多能干細胞(iPS 細胞)來源的腦類器官已被用于評估化療藥物紫杉醇引起的神經毒性,證明了類器官在評估小分子誘導的神經毒性方面的實用性。
心臟毒性
盡管預測性臨床前檢測方法已得到開發和應用,但心臟毒性仍是導致藥物研發失敗和上市后撤市的主要原因。由干細胞衍生的心肌細胞和支持細胞類型組成的類心臟器官應能重現心臟組織結構、收縮功能和電生理學等關鍵特征,從而為預測藥物對心臟的影響提供一種替代方法。
多柔比星誘導的心臟毒性已在心臟類器官模型中得到模擬。多柔比星暴露會降低類器官的活力,增加乳酸脫氫酶(LDH)和腦鈉肽(BNP)水平,并誘導細胞凋亡、纖維化和線粒體功能障礙。在無細胞外基質的模型中,多柔比星治療會導致類器官、節律性受損、膠原沉積、成纖維細胞活化以及內皮細胞向間充質細胞轉化的早期跡象。在模擬缺血后組織的心肌梗死類器官模型中,多柔比星會加劇缺氧敏感性損傷,破壞協調收縮所需的鈣循環,并促進梗死核心區域纖維化的出現。心臟類器官平臺已被用于篩選一系列臨床相關藥物。一項評估美國食品召回化合物的研究表明,類器官比二維單層細胞更有效地檢測到劑量依賴性的 ATP 耗竭和節律紊亂。此外,高通量篩選還發現了針對 GSK3、TGFβ 和甲羥戊酸途徑的促增殖化合物,這些化合物能刺激心肌細胞增殖,但同時會導致收縮時間延長或收縮力下降,表明盡管具有再生潛力,但仍存在功能副作用。空間組織有序的心臟類器官已被用于模擬發育毒性。接觸沙利度胺會減少心臟組織的形成并損害其功能,較大的結構顯示出更穩定的跳動模式,而較小的結構則表現出舒張延遲和形態變異。最后,多器官平臺突顯了其他組織中的代謝如何驅動心臟毒性。在肝心共培養中,通過細胞色素 P450 酶將轉化為去甲基,會導致心臟類器官跳動減少、鈣離子流紊亂和細胞死亡,而當沒有肝類器官時則未觀察到這些效應,這表明肝細胞是導致觀察到的毒性的原因。一個由六種組織構成的平臺同樣表明,卡培他濱和異環磷酰胺在肝臟中的代謝會在下游引發心臟毒性反應,這突顯了器官間相互作用在心臟毒性中的作用。
基于類器官的臨床前安全性評估平臺
目前,人們正在探索傳統類器官預測現有藥物安全性的能力,但新一代具有更高復雜性的生物工程類器官平臺已展現出進一步提升藥物安全性測試的能力(圖 3b)。這類模型融合了血管和免疫成分,能夠研究藥物對組織微環境和全身反應的影響,或者內置實時檢測 ATP 與 ADP 比值的生物傳感器,以評估藥物引起的腎毒性 198。此外,將肝臟、心臟、肺、血管、睪丸、結腸和大腦等多類器官組合在一起的多器官類器官系統已被用于“人體芯片"平臺,能夠對被美國食品召回的藥物進行篩選,并為多器官毒性和全身相互作用提供見解。同樣,由肝臟和胰島類器官組成的微工程組裝體被用于測量二甲雙胍的活性。
近年來,生物工程改造的二維類器官,如微型結腸和微型腸道芯片平臺,通過維持類器官的分化和頂基極性,同時借助流體流動實現腔內通路,進一步拓展了藥物安全性評估的能力(圖 3a)。在這種設置中,三維類器官被“打開",其外側或基底表面置于二維基質上,而類器官的內側/腔內/頂側表面則可以從上方自由接觸。這已被證明對測試針對干細胞的癌癥化療藥物(如阿糖胞苷和伊達薩努林)特別有效。這些將類器官生物學與生物工程方法相結合的平臺為解決具有日益復雜作用機制的治療藥物所面臨的轉化安全性挑戰提供了新的選擇。此外,基于 Transwell 的類器官單層細胞還能利用跨上皮電阻(TEER)測量對上皮屏障完整性進行定量評估,從而提供一種動態的組織極化和緊密連接功能讀數 。值得注意的是,作為跨內皮電阻(TEER)測量的替代方法,基于圖像的檢測方法也已用于測定體外完整腸類器官的屏障完整性,這些方法要么是在培養基中添加熒光染料,然后觀察其在屏障降解時的內化情況,要么是直接將染料微注射到類器官的腔內空間,然后量化上皮屏障的滲漏情況。
類器官吸收和代謝的檢測
預測藥物吸收、分布和代謝的能力對于藥物開發至關重要,直接影響藥物的藥代動力學,從而影響治療候選藥物的預期療效、安全性和劑量。了解這些參數對于優化藥物配方、減輕不良反應以及確保臨床成功至關重要。肝臟、腸道和腎臟是負責藥物吸收、代謝和清除的主要器官,因此也是制藥行業主要關注的體外器官模型。
用于藥物代謝的肝類器官
肝臟是藥物代謝的主要器官,它促進三個關鍵過程:某些藥物向肝臟的主動攝取、生物轉化生成代謝物以及藥物和代謝物向膽汁的分泌。目前的體外模型,如短期懸浮的冷凍保存原代肝細胞或肝細胞共培養系統,可用于測定藥物的固有清除率。然而,這些模型存在局限性,比如無法復制肝臟的代謝和轉運表型(原代人肝細胞在培養中會迅速退化)、細胞與培養基的比例欠佳從而影響代謝和轉運過程的可測量性,以及評估膽汁分泌的能力有限。肝細胞系表達的藥物代謝酶和轉運蛋白水平較低,限制了其預測人體藥代動力學的能力。為解決這一問題,已開發出一種源自 TSC 的肝類器官系統,該系統表達廣泛的 I 相藥物代謝酶(如對藥物進行化學修飾的細胞色素 P450 酶 CYP3A4 和 CYP2D6)、II 相酶(如將這些代謝物結合以促進其排泄的 UDP-葡糖醛酸轉移酶和磺基轉移酶)以及藥物轉運蛋白(包括陰離子轉運蛋白 OATP1B3、ATP 依賴性轉運酶 ABCB1(也稱為 MDR1)和 MRP3)。該系統與微流控芯片集成,已被用于研究咪MI達DA唑CUO侖LUN的代謝和生物利用度,以及香XIANG豆DU素和二甲雙胍在結合了腸和腎類器官的多器官平臺中的排泄情況。此外,肝內膽管細胞類器官(ICOs)已被用于評估對乙酰氨基酚、羥基咪MI達DA唑CUO侖LUN和 7-羥基香XIANG豆DU素葡萄糖醛酸酯的代謝產物形成。盡管 ICOs 成功模擬了代謝產物的生成,但其 CYP 酶的表達水平低于原代人肝細胞,這凸顯了進一步優化以匹配原代組織功能的必要性。
用于藥物代謝和轉運的腸類器官
早期的概念驗證研究已表明,腸道類器官系統有助于更好地理解和預測腸道吸收及代謝情況。地塞米松、β-萘黃酮以及組成型雄烷受體激動劑 TCPOBOP 能夠成功誘導源自 TSC 的腸道和肝臟類器官中 CYP 酶的活性,從而為藥物代謝研究提供了可能。實際上,源自小鼠的隱窩類器官已被用于研究腸道藥物代謝酶(DMEs),結果顯示前體藥物 CPT-11 能夠轉化為其有毒代謝物 SN-38。人十二指腸類器官被用于研究肽類藥物的轉運,證明了頭孢羥氨芐、β-內酰胺類抗生素和環六肽的吸收。此外,基于 Transwell 的二維單層系統有助于雙向(頂面/底面)運輸研究(圖 3a)。如上所述,這種二維設置始于 三維類器官被打開并置于二維基質上。向三維類器官上皮細胞的頂側遞送化合物需要向類器官腔內注射,而二維 Transwell 裝置則可方便地接觸到上皮結構的頂側和基側(圖 3a)。因此,富含腸上皮細胞的極化人十二指腸類器官單層培養成功區分了高通透性和低通透性化合物,顯示出包括 MDR1 和 BCRP 在內的主要外排轉運蛋白的功能活性。此外,三維十二指腸和結腸類器官表現出對 I 相和 II 相藥物代謝酶的代謝活性,且各段的差異與已知的藥物代謝酶表達譜一致。為了直接接觸頂側表面,已生成了上皮極性反轉的 。
采用類器官進行藥物吸收、分布、代謝和排泄(ADME)研究
類器官在吸收、分布、代謝和排泄(ADME)領域的應用仍有限。關鍵挑戰包括肝臟和腎臟類器官分化相對不成熟。此外,盡管動物體內藥代動力學研究存在可轉化性方面的限制,但其相對簡便性往往超過了基于類器官平臺預測的潛在優勢。評估藥物的 ADME 參數需要一個具有體內酶活性代表性、能模擬人體生理屏障功能且擁有足夠組織量(數百萬細胞)以催化藥物生物轉化的平臺。盡管如此,類器官開始被用于解決與 ADME 相關的問題。盡管存在技術挑戰,但類器官在滿足 ADME 測試需求以及解決跨模式藥物代謝預測的關鍵行業難題方面展現出前景。對于小分子而言,其主要優勢在于能夠模擬相關的轉運、屏障功能和生理代謝活動。近期在具有功能性肝膽結構的肝類器官GUAN方面的進展有助于解決評估藥物膽汁清除率方面的關鍵空白,而腎臟類器官開發方面的進展則有可能用于增強藥物腎排泄的臨床前評估。類器官能夠真實地復制靶組織表達的能力對于大分子結合評估、靶點評估以及靶點介導的藥物處置特別有吸引力。流體連接的類器官組織與血管類器官的組合有望通過實現重復采樣和對藥物代謝及向靶組織輸送的精確評估來應對藥代動力學和組織分布方面的挑戰。
當前挑戰的潛在解決方案
如上所述,類器官技術在藥物開發中的廣泛應用仍面臨諸多障礙。其中一個障礙在于,盡管類器官比細胞系復雜得多,但它們仍是一種簡化的模型,缺乏真實組織中的關鍵成分。大多數類器官沒有血管,這限制了營養物質和氧氣的輸送,從而影響其生長、成熟和功能,尤其是在較大的類器官中。由于大多數藥物是通過靜脈注射給藥的,類器官模型中缺乏血管化給藥物的準確評估帶來了挑戰。類器官培養通常不包含免疫細胞,因此對免疫反應、炎癥或免疫治療相互作用的分析頗具難度。其他復雜的組織成分,如細胞外基質、基質細胞和神經元在類器官中也不存在,這影響了其功能和疾病建模能力。類器官無法模擬系統性相互作用,如激素信號傳導或多器官間的相互作用。原生組織會受到生物力學力的作用,如切應力、拉伸和壓力,這些在類器官培養中很難重現。另一個主要障礙是類器官培養的變異性,這會導致難以實現可重復性:不同實驗室之間的培養方案存在差異,例如細胞來源、培養基成分和生長條件的不同,會導致類器官發育的不一致;來自不同患者捐贈者的細胞遺傳多樣性會導致不同批次類器官之間的差異;實現統一和可控的分化或功能仍然具有挑戰性,這會導致類器官批次內部和批次之間的異質性;數據分析通常需要復雜的定制分析工具,這也增加了研究過程和結論的復雜性。這些局限性反過來又使類器官難以作為高通量篩選和大規模藥物測試的標準化模型。同樣,藥物開發的可擴展性仍是一個挑戰。要克服這些挑戰,需要在培養方案方面取得進展,將微流控技術整合進來,并提高模型的復雜性,這些舉措共同作用將使類器官充分發揮其作為個性化醫療和藥物研發可靠工具的潛力。
基于類器官的藥物篩選常規流程包括將類器官嵌入基質中,并將其接種到多孔板中,然后在上面添加培養基。自動化機器人技術和液體處理系統能夠簡化這一過程(圖 4a)。這種方法已被用于源自乳腺癌和結直腸癌(CRC)的 PDTO 藥物篩選。然而,該方法無法精確控制接種類器官的數量和空間分布,從而限制了高通量篩選(HTS)實驗的可重復性。
生物工程微流控裝置能夠快速生成大量嵌入小體積細胞外基質(如基質膠)中的類器官。基質膠是從恩格爾布雷思-霍爾姆-斯瓦姆(Engelbreth–Holm–Swarm)小鼠肉瘤中提取的可溶性基底膜,富含細胞外基質蛋白(層粘連蛋白 111、Ⅳ型膠原和纖連蛋白),能支持極性和存活。這些裝置將類器官播種在多孔板、微孔/微陣列或微柱芯片中(圖 4a–d),能夠精確控制類器官的形狀、大小和細胞數量,從而極大地提高了均一性和可重復性(圖 4b)。這類系統非常適合高通量篩選,因為其檢測方法需要簡單且可靠。理想情況下,生成的類器官應位于均勻的水平和垂直平面上,以便于基于成像的表型分析。例如,嵌入多孔板中的微工程水凝膠薄膜能夠同時在相同的焦平面上生成數千個均勻的類器官,這些類器官被固定在微腔陣列中,從而能夠對數千個單獨的結直腸癌類器官進行實時自動成像,以評估抗癌藥物的效果。利用微流控技術進行高通量的基質膠包埋類器官液滴打印,既能確保類器官間的同質性,又能保留組織異質性,從而能夠準確預測藥物反應,與患者的實際治療效果相吻合。這種小液滴的格式——因其較大的表面積與體積比——還能實現高效的病毒感染和 T 細胞滲透,已被應用于 SARS-CoV-2 藥物測試和快速嵌合抗原受體(CAR)-T 細胞效力檢測。微孔陣列(圖 4c)已被用于分析肺癌類器官,能在一周內預測藥物反應;而 384 微柱板中培養的 3D 神經干細胞(圖 4d)則可用于大規模化學文庫的神經毒性篩選。
這些 3D 高通量平臺通常使用生物相容性涂層基質,如聚二甲基硅氧烷、聚甲基丙烯酸甲酯、水凝膠或基質膠,以維持類器官的 3D 結構并支持細胞生長。對于某些類器官類型,例如腦類器官和肝組裝體,可采用無基質懸浮培養,使用帶有轉子裝置的超低附著板。這些懸浮培養也可集成到微流控系統中,以生成用于高通量篩選試驗的大小可控且均勻的類器官。
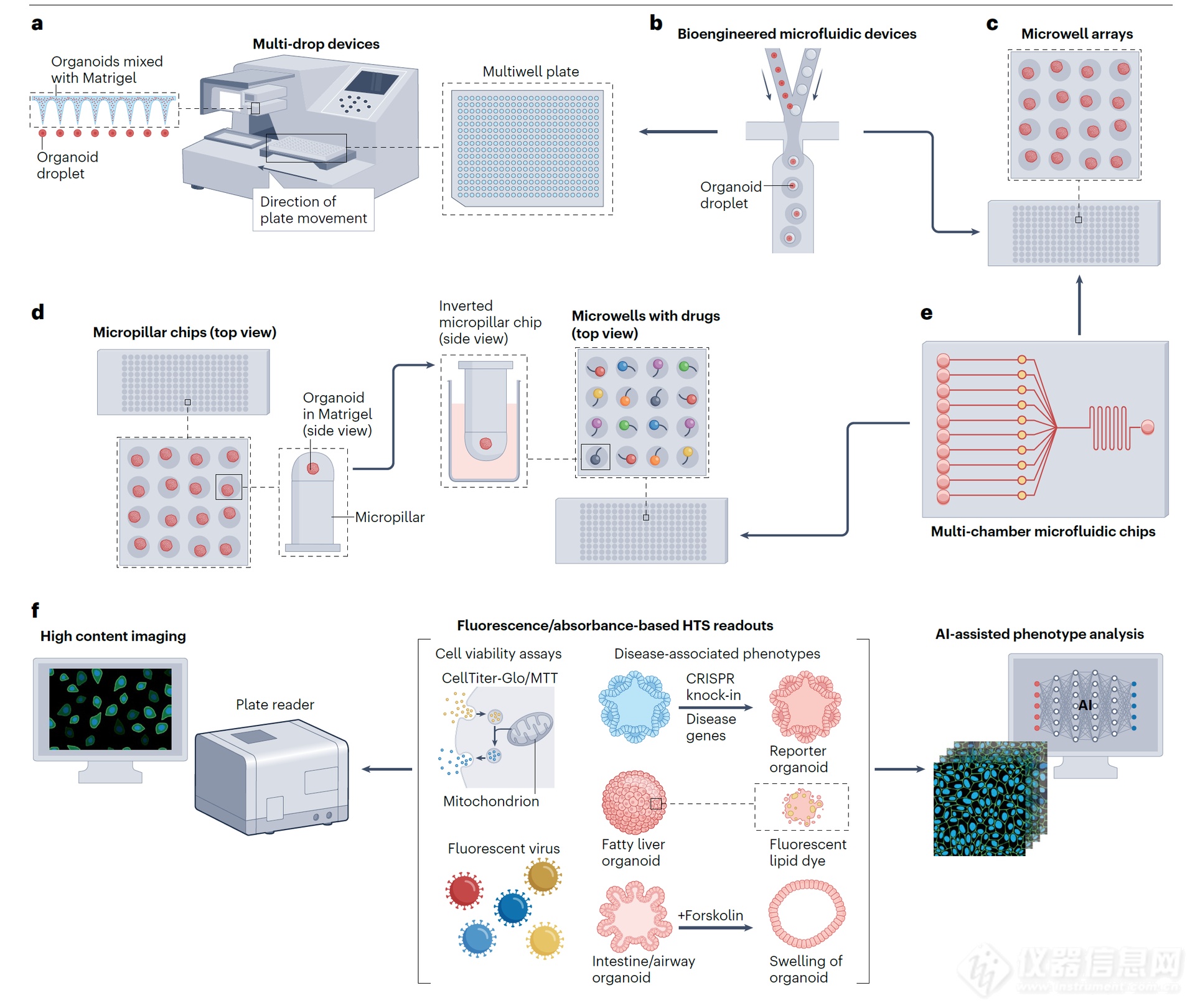
圖 4 | 自動化高通量藥物篩選策略。a,一種傳統方法,使用多滴裝置將類器官 - 基質膠混合物自動接種到多孔板中。b,生物工程微流控裝置能夠快速生成大量重復的類器官液滴,對其形狀、大小和細胞數量進行精確控制。c,d,這些類器官液滴隨后可被引入多孔板(圖 a)、微孔陣列(圖 c)或微柱芯片(圖 d)中進行進一步的藥物評估。不同顏色表示微孔中的不同藥物。e,多腔室微流控芯片可用于高通量篩選(HTS),只需將類器官細胞直接接種到腔室中即可,或者它也可以形態學終點正逐漸被采用以提高類器官研究的通量和標準化。類器官可以固定在福爾馬林中并包埋在石蠟中(FFPE),或者新鮮冷凍并包埋在切割溫度化合物或明膠中。組織微陣列可以將一整塊 96 孔板的類器官無縫整合到現有的高通量篩選(HTS)設置中(例如,微孔或微柱芯片),以促進藥物遞送。f,基于熒光或吸光度讀數的自動化成像和數據處理,借助人工智能(AI)驅動的算法。高通量篩選讀數的示例包括細胞活力測定,如 CellTiter-Glo 或 MTT,用于感染性疾病藥物篩選的熒光病原體,以及基于疾病相關表型的評估,例如疾病標志物的表達、疾病酶的活性、用于監測代謝疾病中代謝物動態的熒光染料以及與疾病相關的形態變化。嵌入 FFPE 塊中,為人工智能(AI)支持的定量圖像分析提供了工具,這一技術源自新興的數字病理學領域。這使得分子病理學方法的應用成為可能,包括免疫組織化學、多重免疫熒光、空間轉錄組學和電子顯微鏡技術。
監管機構的挑戰與機遇
盡管類器官具有諸多優勢,但在其能夠順利融入藥物研發流程之前,監管機構的認可仍是一大障礙。解決這些難題將有助于加強藥物安全性評估,促進更有效療法的開發,并減少對動物實驗的依賴。
類器官在藥物安全性測試中的應用
在藥物安全性測試中,類器官應用的主要挑戰在于模型鑒定、可重復性、臨床轉化、成本效益優化以及監管機構的認可。為了支持人體臨床試驗,臨床前測試通常結合體內和體外模型,以ZUI大限度地提高臨床預測性,同時減少動物使用。當需要功能性和生理相關性終點時,類器官可以補充傳統的二維細胞培養檢測,特別是在解決機制問題方面,但目前監管申報更傾向于使用復雜度較低、通量較高且成本較低的體外工具。要實現更廣泛的應用,必須證明其相對于傳統方法具有明顯優勢,例如在特定使用情境下具有更強的預測能力。此外,擴大在不同使用情境和治療方式下的鑒定工作,對于增強人們對類器官相對于更簡單的傳統體外方法的預測價值的信心至關重要。重要的是,盡管類器官在預測毒性方面作為轉化模型展現出前景,但這里介紹的大多數研究仍屬于臨床前的概念驗證工作,與體內和患者數據的驗證仍有限。要將類器官確立為轉化標準,還需要進行更多的正向和反向轉化研究。
類器官在臨床前藥物開發中的應用通常分為兩類:內部決策(例如篩選和機制研究)以及納入監管申報材料。制藥公司已在選定的使用場景中將類器官用于探索性和機制性研究,但這些研究很少在決定臨床試驗安全性方面起關鍵作用。
類器官的復雜性也帶來了實際的障礙。其構建和維護需要大量的時間、資源和技術專長,通常還需要成像和數據分析流程。對于資源有限或使用場景零星的組織來說,在內部維持這種專長往往是不切實際的。將工作外包給擁有大量基于類器官項目的專業合同研究組織,這些組織具備穩固的商業模式,是一種可行的替代方案。此外,努力實現標準化和自動化流程以及簡化工作流程對于充分發揮類器官的更廣泛效用以及確保其融入藥物開發流程至關重要。
用于藥物開發的類器官監管框架
在首SHOU次人體臨床試驗前進行非臨床研究的目標是評估產品的藥理活性,并確保在 I 期臨床試驗中健康志愿者或患者的安全。對于人類藥物開發,美國食品(FDA)的規定并未明確要求用于支持臨床試驗的藥物在人體中具有合理安全性的非臨床研究的類型或設計(無論是體內、體外還是計算機模擬研究)。盡管動物毒性研究對于識別潛
在的人類風險至關重要,但尋找減少動物使用并開發有效替代方法的途徑是一項重要工作。在監管背景下,對于諸如類器官等更具人類預測性的轉化平臺和技術的需求巨大,這些平臺和技術被定義為新方法學(NAMs)29,262。2022 年,美國國會通過了《FDA 現代化法案 2.0》(參見文獻 30),隨后又通過了《法案 3.0》(參見文獻 31),明確了在藥物開發中對動物試驗的感知要求。這要求 FDA 建立一條途徑,使相關實體能夠申請批準特定使用情境下的非臨床測試方法。為此,美國食品(FDA)啟動了“替代方法計劃",首先,擴大流程以確認替代方法可用于監管;其次,為外部利益相關者開發替代方法提供明確的指導方針;第三,通過應用研究信息空白,以推進新政策和指導方針的制定。最近,FDA 宣布計劃在實驗室環境中用一系列方法取代單克隆抗體療法和其他藥物開發中的動物試驗,包括基于人工智能的毒性計算模型、細胞系和類器官毒性測試。
然而,要將類器官成功應用于臨床前測試流程,就需要對其進行恰當的表征、驗證和鑒定,以向終端用戶以及衛生主管部門證明其適用于特定用途或使用情境(見方框 3)。經濟合作與發展組織(OECD)對驗證原則進行了詳盡闡述,為如何針對特定使用情境評估類器官提供了有用的指導。這種評估對于監管環境中使用的方法來說是標準流程。目前,跨行業聯盟和衛生主管部門正在共同努力,以實現對包括類器官在內的非動物模型的監管認可,重點在于制定標準和培訓相關方法。理想情況下,由生物工程師、生物學家、毒理學家和病理學家等不同領域的科學家團隊共同開發類器官模型,并對其使用情境進行綜合評估。
監管展望
目前,只有少數基于細胞的測試方法被經合組織測試指南所描述。大多數毒性測試仍屬于非指南方法。最近,美國食品(FDA)和歐洲藥品管理局(EMA)都提出了推進非動物方法(NAMs)監管認可的路線圖。
方框3 | 監管指南
在經濟合作與發展組織(OECD)層面,有三份與體外方法開發和使用相關的指導文件:《Guidance Document on Good In Vitro Method Practices體外方法實踐指導文件》(GIVIMP)、《Guidance Document for Describing Non-Guideline In Vitro Test Methods描述非指南性體外測試方法指導文件》(GD211)以及《Guidance Document on the Validation and International Acceptance of New or Updated Test Methods for Hazard Assessments新的&更新的危害評估測試方法的驗證和國際認可指導文件》(GD34)。GD34 和 GD211 支持對類器官進行詳盡的描述、表征和驗證,以增強其可信度。表征可以包括對類器官的生物學相關性和科學有效性的評估,而驗證則指的是為特定使用情境確立特定檢測方法的可靠性和相關性的過程。
例如,在藥物開發方面,歐洲藥品管理局(EMA)的自愿提交數據程序,也稱為“安全港"方法,旨在允許生成、匯編和審查數據,以幫助確定新替代方法(NAM)的使用范圍。此外,EMA 評估特定使用范圍內給定 NAM 的監管接受程度及其局限性。這一過程旨在增強對 NAM 的信心,并可能支持基于定義的使用范圍起草資格標準,從而指導模型開KAI發者如何為監管應用對新型模型進行資格認定。美國食品(FDA)的路線圖側重于在數年內逐步用替代方法取代單克隆抗體和其他藥物的動物試驗。
因此,在監管申報中逐步將類器官納入非動物模型,以替代、減少和優化動物模型,具有潛力。然而,這不應損害藥品評估所要求的既定標準。至關重要的是要保持謹慎的平衡——接納包括類器官在內的這些創新方法,同時堅守歐洲藥品監管網絡的嚴格標準。
結論
在藥物開發中使用類器官為臨床前研究提供了向更準確、更貼近患者實際情況的模型邁進的巨大飛躍。正如所描述的那樣,類器官為重現人體組織的復雜性提供了一個平臺,相較于傳統的二維細胞培養和動物模型,它能提供更符合生理條件的環境。然而,盡管該領域已取得重要進展,但仍面臨諸多挑戰。類器官培養的可擴展性和可重復性,尤其是在高通量篩選(HTS)的背景下,仍需進一步改進。這將需要持續開發和驗證標準化、自動化的類器官平臺,并建立明確的監管框架以促進行業采用。此外,提高類器官對人類治療反應的預測能力——尤其是在癌癥、神經退行性疾病、慢性炎癥和代謝疾病等復雜疾病方面——還需要在血管化、免疫系統整合和多器官建模方面進行創新,同時結合單細胞組學、高速圖像采集和人工智能支持的數據分析等前沿分析技術。隨著技術的成熟,我們預計基于類器官的平臺將成為藥物研發流程中的一部分,彌合基礎科學與臨床結果之間的差距。類器官可能會改變我們理解和治療疾病的方式,其在藥物開發中的未來前景廣闊。

